Медицинский эксперт статьи
Новые публикации
Препараты
Нейролептики, или антипсихотики
Последняя редакция: 09.08.2022

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Антипсихотики (нейролептики) - класс психотропных средств, преимущественно используемых для лечения шизофрении. В настоящее время принято выделять две группы (или категории) препаратов: типичные и атипичные антипсихотики. Ниже приведены данные о фармакологических свойствах, показаниях для назначения и побочных эффектах терапии каждой из этих групп препаратов.
Показания для назначения типичных антипсихотиков
В настоящее время к числу основных показаний для назначения традиционных нейролептиков согласно рекомендациям, приводимым авторитетными исследователями в области психофармакотерапии, относят следующие.
- Купирование психомоторного возбуждения и нарушения поведения, которые обусловлены выраженной психотической симптоматикой. В этих случаях показано применение пероральных или парентеральных форм препаратов, обладающих антипсихотическим действием как глобальным (хлопромазин, левомепромазин, тиопроперазин, зуклопентиксол), так и избирательным - в виде воздействия на галлюцинаторно-параноидные расстройства (галоперидол, трифлуоперазин).
- Противорецидивная (профилактическая) терапия. С этой целью назначают депонированные формы препаратов, особенно у больных с плохим медикаментозным комплайенсом (галоперидол-деканоат, пролонгированная форма флупентиксола), либо небольшие или средние дозы препаратов для получения дезингибирующего (антинегативного) эффекта, из числа тех средств, высокие дозы которых применяются для купирования острых психотических нарушений (флупентиксол, зуклопентиксол). При этом виде терапии рекомендовано также назначение так называемых малых нейролептиков (тиоридазин. хлорпротиксен, сульпирид), психотропная активность которых состоит из воздействия на проявления депрессивного полюса и диссомнические расстройства.
- Преодоление терапевтической резистентности к атипичным антипсихотикам при купировании острых психотических состояний. С этой целью применяют, как правило, парентеральные формы традиционных антипсихотиков, обладающих глобальным (хлорпромазин, левомепромазин и др.) и селективным (галоперидол) антипсихотическим действием.
Эти препараты вызывают различные побочные эффекты, характер которых зависит от особенностей фармакологического профиля каждого препарата. Антипсихотики с более выраженным холинолитическим действием чаще вызывают нарушения аккомодации, запоры, сухость во рту. задержку мочи. Седативный эффект более свойственен антипсихотикам с выраженным антигистаминным действием, а ортостатическая гипотензия - средствам, блокирующим а1-адренорецепторы. Блокада типичными нейролептиками холинергической, нордренергической и дофаминергической передачи может приводить к ряду нарушений в половой сфере, таких, как аменорея или дисменорея, аноргазмия, галакторея, набухание и болезненность грудных желёз, снижение потенции. Побочные эффекты в половой сфере преимущественно связаны с холино- и адреноблокирующими свойствами этих препаратов, а кроме того - с увеличением секреции пролактина вследствие блокады обмена дофамина. Наиболее серьёзные побочные эффекты типичных нейролептиков - нарушения двигательной функции. Именно они - наиболее частая причина отказа больных от приёма препаратов. К трём основным побочным эффектам терапии, связанным с влиянием на моторную сферу, относят ранние экстрапирамидные синдромы, позднюю дискинезию и ЗНС.
Экстрапирамидные синдромы связаны, как полагают, с блокадой D2-рецепторов в базальных ганглиях. К ним относят дистонию, нейролептический паркинсонизм и акатизию. Проявления острой дистонической реакции (ранней дискинезии) - внезапно развивающиеся гиперкинезы, окулогирные кризы, сокращения мышц лица и туловища, опистотонус. Эти нарушения дозозависимы и часто возникают через 2-5 дней терапии высокопотентными нейролептиками, такими, как галоперидол и флуфеназин. Для купирования ранней дискинезии снижают дозу нейролептика и назначают антихолинергические препараты (бипериден, тригексифенидил). Поздняя дискинезия обычно вовлекает мышцы шеи и, в отличие от острой дистонической реакции, хуже поддаётся лечению холинолитиками. Для нейролептического паркинсонизма характерно снижение способности к спонтанной моторике, гипо- и амимия, тремор покоя и ригидность. Эти симптомы важно отличать от внешне сходных негативных расстройств при шизофрении, представленных эмоциональным отчуждением, притуплением аффекта и анергией. Для коррекции этих побочных эффектов показано применение холинолитиков, снижение дозы нейролептика или его замена на атипичный антипсихотик. Акатизия проявляется внутренним беспокойством, невозможностью долго оставаться на одном месте и потребностью постоянно двигать руками или ногами. Для её купирования применяют холинолитики, а также центральные бета-адреноблокаторы (пропранолол).
Поздняя дискинезия проявляется непроизвольными движениями любой группы мышц, чаще мышц языка и рта. Клинически различают ряд её форм: дискинезия мышц щёк, языка, рта (периодические сокращения жевательных мышц, создающие впечатления гримасничающего человека, язык может непроизвольно высовываться изо рта больного); тардивная дистония и тардивная акатизия; (пациент совершает хореоатетоидные движения головой, туловищем, верхними и нижними конечностями). Эту форму расстройств регистрируют преимущественно при длительном лечении традиционными нейролептиками и выявляют примерно у 15-20% больных, принимавших их в качестве поддерживающей терапии. Вероятно, у части больных риск развития симптомов дискинезии повышен, поскольку некоторые из них наблюдались в клинике шизофрении еще до «нейролептической эры». Кроме того, поздняя дискинезия описана у пожилых женщин и больных аффективными расстройствами. Предполагается, что поздняя дискинезия связана с увеличением числа дофаминовых рецепторов в стриатуме, хотя в её патогенез, вероятно, также вовлечены ГАМК-ергическая и другие нейромедиаторные системы. Эффективного универсального лечения таких побочных эффектов не существует. Предполагают, что назначение малых доз высокопотентных нейролептиков, обладающих дофаминблокирующим действием, или витамина Е может оказывать умеренный благоприятный эффект при этих нарушениях. Наиболее эффективная мера при поздней дискинезии - снижение дозы типичного нейролептика или замена его на атипичный антипсихотик.
Злокачественный нейролептический синдром, по современным данным, наблюдают примерно в 0,5% случаев психофармакотерапии. Вероятно, редкая частота возникновения в настоящее время такого опасного для жизни больного осложнения можно объяснить широким внедрением в практику атипичных антипсихотиков, поскольку риск появления ЗНС при лечении этими средствами незначителен. Принято считать, что главная причина развития ЗНС - избыточная блокада дофаминергической системы при терапии нейролептиками, особенно после повышения дозы высокопотентого антипсихотика. Основные симптомы ЗНС - гипертермия, повышение тонуса скелетной мускулатуры и сухожильных рефлексов, нарушение сознания с переходом в кому. В анализе крови обнаруживается лейкоцитоз, повышение скорости оседания эритроцитов, активности печёночных трансаминаз; в анализе мочи отмечают наличие альбуминурии. Быстро наступают нарушения водного и электролитного баланса, что создаёт предпосылки для формирования отёка головного мозга. ЗНС - острое состояние, требующее срочной госпитализации больного для проведения интенсивной инфузионной терапии. В лечении ЗНС наиболее важна гидратация и симптоматическая терапия. В такой ситуации любые назначенные нейролептики требуют немедленной отмены. В некоторых случаях положительное действие оказывают агонисты дофаминовых рецепторов (например, бромкриптин) или миорелаксанты, хотя их эффективность не исследована. После устранения ЗНС не следует возобновлять приём нейролептика в течение как минимум двух недель. В дальнейшем возможно назначение низкопотентного антипсихотика, предпочтительно - препарата нового поколения. Дозу вновь назначенного средства следует наращивать крайне осторожно, контролируя состояние жизненно важных функций и лабораторные данные (анализы крови, мочи).
Типичные нейролептики сравнительно редко вызывают опасные смертельные осложнения. Проявления передозировки преимущественно связаны с индивидуальным профилем антиадренергического и антихолинергического действия препарата. Поскольку эти средства обладают сильным противорвотным действием, для их устранения из организма показано промывание желудка, а не назначение рвотных средств. Артериальная гипотензия, как правило, следствие блокады адренорецепторов, и её следует коррегировать введением допамина и норэпинефрина. При нарушении сердечного ритма показано применение лидокаина.
Механизм действия и фармакологические эффекты типичных антипсихотиков
По мере развития психофармакологии были предложены различные варианты влияния антипсихотиков на нейрорецепторы. Основной остаётся гипотеза об их воздействии на дофаминовые нейроструктуры (прежде всего, на рецепторы D2), основанная на данных о нарушении при психозах нормального обмена дофамина в структурах головного мозга. Дофаминовые D2-рецепторы расположены в базальных ганглиях, прилежащем ядре и коре лобных долей, они играют ведущую роль в регуляции потока информации между корой полушарий и таламусом.
Рисунок демонстрирует уточнённые представления о нарушениях дофаминовой передачи в кортикальных и субкортикальных областях головного мозга и роль этих нарушений в развитии симптомов шизофрении (адаптировано из монографии Jones Р.В., Buckley P.F., 2006).
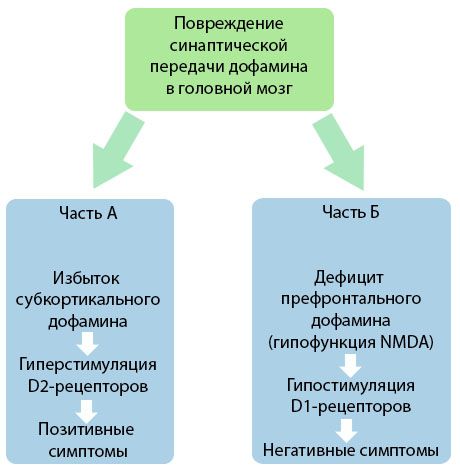
Часть «А» отражает классическую, раннюю дофаминовую теорию, постулирующую избыток дофамина в субкортикальных областях и гиперстимуляцию D2-рецепторов, которая приводит к возникновению продуктивных симптомов. Часть «Б» демонстрирует последующую модернизацию теории в начале 90-х гг. прошлого века. Данные, полученные к этому времени, выявили, что дефицит дофамина в рецепторах D; вместе с недостаточной стимуляцией этих рецепторов префронтальной коры приводит к возникновению негативных симптомов и когнитивного дефицита. Поэтому, согласно современному пониманию, оба типа нарушений дофаминергической передачи - переизбыток субкортикального дофамина и его дефицит в префронтальной коре - являются суммарным результатом нарушения синаптической передачи в префронтальной области и связаны с гипофункцией N-метил-N-аспартата. Кроме первоначально выделенного дофамина, позднее были определены и другие нейротрансмиттеры, принимающие участие в патогенезе шизофрении, такие, как серотонин, гаммааминобутировая кислота, глутамат, норадреналин, ацетилхолин и различные нейропептиды. Хотя роль этих медиаторов не до конца изучена, тем не менее по мере развития знаний становится понятно, что манифестация многочисленных нейрохимических сдвигов в организме. Поэтому клинический эффект антипсихотического препарата представляет собой суммацию воздействий на различные рецепторные образования и приводит к устранению нарушении гомеостаза.
В последние годы в связи с появлением новых методов исследования так как связывание радиоизотопных лигандов и сканирующая ПЭТ, значительный прогресс произошел в области выяснения тонких биохимических механизма действия нейролептиков. В частности, определена сравнительная сила и тропность препаратов к связыванию с отдельными нейрорецепторами в различных областей и структурах мозга. Показана прямая зависимость выраженности антипсихотического эффекта препарата от силы его блокирующего воздействия на различные дофаминергические рецепторы. В последнее время выделяют четыре типа таких рецепторов:
- D1 находятся преимущественно в зоне чёрного вещества и полосатого тела (так называемая нигростриальная область), а также префронтальной области;
- D2 - в нигростриальной, мезолимбической областях и передней доле гипофиза (секреция пролактина);
- D3 (пресинаптические) - в различных структурах мозга, контролируют дофаминергическую активность по закону отрицательной обратной связи;
- D4 (пресинаптические) - преимущественно в нигростриальной и мезолимбической областях.
Вместе с тем в настоящее время можно считать доказанным тот факт, что именно блокада D2-рецепторов служит причиной развития антипсихотического, вторичного седативного эффектов, а также экстрапирамидных побочных явлении Другими клиническими проявлениями блокады этого типа рецепторов служат анальгезирующее и антиэметическое действие нейролептиков (уменьшение тошноты, рвоты в результате угнетения рвотного центра), а также снижение содержания гормона роста и увеличение выработки пролактина (нейроэндокринные побочные эффекты, включая галакторею и нарушения менструального цикла). Длительная блокада нигростриальных D2-рецепторов приводит к появлению их гиперчувствительности, ответственной за развитие поздних дискинезий и «психозов сверхчувствительности». Вероятные клинические проявления блокады пресинаптических D3- и D4-рецепторов связаны преимущественно со стимулирующим эффектом нейролептиков. Благодаря частичной блокаде этих рецепторов в нигростриальной и мезолимбокортикальной областях активирующие и инцизивные (мощные, высокоактивные) нейролептики в небольших дозах могут стимулировать, а в высоких дозах подавлять дофаминергическую передачу.
В последние годы резко возрос интерес к функции серотонинергических систем мозга, в том числе серотониновых рецепторов. Дело в том, что в различных отделах мозга серотонинергическая система оказывает модулирующее влияние на дофаминергические структуры. В частности, в мезокортикальной области серотонин угнетает высвобождение дофамина, соответственно блокада постсинаптических 5-НТ-рецепторов ведёт к увеличению содержания дофамина. Как известно, развитие негативной симптоматики при шизофрении связывают с гипофункцией дофаминовых нейронов в префронтальных структурах коры большого мозга. В настоящее время известно около 15 типов центральных 5-НТ-рецепторов. Экспериментально обнаружено, что нейролептики связываются в основном с 5-НТ-рецепторами первых трёх типов.
На 5-НТ1а-рецепторы эти препараты оказывают в основном стимулирующий (агонистический) эффект. Вероятные клинические последствия; усиление антипсихотической активности, уменьшение выраженности когнитивных расстройств, коррекция негативной симптоматики, антидепрессивное действие и снижение числа экстрапирамидных побочных явлений.
Существенное значение имеет воздействие нейролептиков на 5-НТ2-рецепторы, особенно на подтипы 5-НТ2а. Они находятся преимущественно в коре мозга и их чувствительность у больных шизофренией повышена. С блокадой 5-НТ2а-рецепторов связывают способность нейролептиков нового поколения уменьшать выраженность негативной симптоматики, улучшать когнитивные функции, регулировать сон за счёт увеличения общей продолжительности медленноволновых (Д-волны) стадий сна, уменьшать агрессивность и ослаблять депрессивную симптоматику и мигренеподобные (возникающие вследствие сосудисто-мозговых нарушений) головные боли. С другой стороны, при блокаде 5-НТ2а-рецепторов возможны усиление гипотензивных эффектов и нарушение эякуляции у мужчин.
Считают, что воздействие нейролептиков на 5-НТ2с-рецепторы вызывает седативный (анксиолитический) эффект, усиление аппетита (сопровождающееся увеличением массы тела) и уменьшение выработки пролактина.
5-НТ3-рецепторы находятся преимущественно в лимбической области, и при их блокаде прежде всего развивается антиэметический эффект, а также усиливается антипсихотическое и анксиолитическое действие.
Возникновение паркинсоноподобной симптоматики зависит также от блокирующей силы препарата на мускариновые холинергические рецепторы. Холинолитическое и дофаминблокирующее действия в известной мере находятся в реципрокных отношениях. Известно, например, что в нигростриальной области D2-рецепторы сдерживают высвобождение ацетилхолина. При блокаде более 75% D2-рецепторов в нигростриальной области баланс нарушается в пользу холинергической системы. Именно этим обусловлено корригирующее влияние на нейролептические экстрапирамидные побочные эффекты холинолитических препаратов (корректоров). Хлорпротиксен, клозапин и оланзапин обладают высокой тропностью к мускариновым рецепторам и практически не вызывают экстрапирамидных побочных эффектов, так как блокируют одновременно холин- и дофаминергические рецепторы. Галоперидол и производные фенотиазина пиперазинового ряда оказывают выраженное воздействие на дофаминовые рецепторы, но очень слабо влияют на холиновые. Этим обусловлена их способность вызывать выраженные экстрапирамидные побочные явления, которые уменьшаются при применении очень высоких доз, когда холинолитическое влияние становится ощутимым. Помимо уменьшения дофаминблокирующего действия на D2-рецепторы нигростриальной области и нивелирования экстрапирамидных побочных эффектов, сильное холинергическое влияние может обусловливать ухудшение когнитивных функций, в том числе мнестические расстройства, а также периферические побочные эффекты (сухость слизистых оболочек, нарушение аккомодации зрения, запоры, задержка мочи, спутанность сознания и т.д.). Достаточно сильное блокирующее воздействие нейролептики оказывают на гистаминовые рецепторы I типа, с чем связывают, прежде всего, выраженность седативного эффекта, а также увеличение массы тела вследствие усиления аппетита. Антиаллергическое и противозудное действие нейролептиков также связывают с их антигистаминными свойствами.
Помимо дофаминблокирующего, антисеротонинергического, холинолитического и антигистаминного эффектов большинство нейролептиков обладают адренолитическими свойствами, т.е. блокируют как центральные, так и периферические a1-адренорецепторы. Такие адреноблокаторы, как хлорпромазин и хлорпротиксен, оказывают выраженное седативное действие. Кроме того, блокирующее действие этих препаратов бывает причиной нейровегетативных побочных эффектов (артериальная гипотензия, тахикардия и т.д.), а также усиления гипотензивного эффекта адреноблокаторов.
В работах большого числа авторов приведены данные о силе связывания (аффинитете) отдельных нейролептиков с различными видами нейрорецепторов.
По нейрохимическому профилю действия типичные и атипичные антипсихотики из числа преимущественно использующихся в клинической практике можно условно разделить на шесть групп.
Первую группу составляют избирательные блокаторы D2- и D4-рецепторов (сульпирид, амисудьприд, галоперидол и др.) из групп производных бензамида и бутирофенона. В небольших дозах преимущественно за счёт блокады пресинаптических D4-рецепторов они активируют дофаминергическую передачу нервных импульсов и оказывают стимулирующее (дезингибирующее) действие, в больших дозах - блокируют D2-рецепторы во всех областях мозга, что клинически проявляется выраженными антипсихотическим эффектом, а также экстрапирамидными и эндокринными (ввиду пролактинемии) побочными расстройствами.
Ко второй группе относят высокоактивные блокаторы D2-рецепторов, а также лекарственные средства, слабо или умеренно блокирующие 5-НТ2а- и 5-НТ1a-рецепторы (флупентиксол, флуфеназин, зуклопентиксол и др.), т.е. в основном пиперазиновые производные фенотиазина или близкие к ним по стереохимической структуре тиоксантены. Как и препараты первой группы, эти нейролептики оказывают, прежде всего, ярко выраженное антипсихотическое (инцизивное) действие, а также вызывают экстрапирамидные пъэочные эффекты и пролактинемию. В малых дозах они оказывают умеренно активирующее (психостимулирующее) действие.
Третью группу составляют; поливалентные седативные нейролептики, недифференцированно блокирующие большинство нейрорецепторов. Эти лекарственные средства оказывают отчётливо выраженное блокирующее действие на дофаминовые рецепторы, а также вызывают сильный адренолитический и холинолитический эффекты. Сюда относят большинство седативных нейролептиков, прежде всего алифатические и пиперидиновые производные фенотиазина, а также близкие к ним по стереохимической структуре тиоксантены (хлорпромазин, левомепромазин, хлорпротиксен и др.). В спектре психотропной активности данных препаратов преобладают, прежде всего, ярко выраженный первичный седативный эффект, развивающийся независимо от применяемой дозы, и умеренный антипсихотический эффект. Кроме того, лекарственные средства данной группы из-за резко выраженного холинолитического действия вызывают слабые или умеренно выраженные экстрапирамидные и нейроэндокринные побочные эффекты, но часто приводят к развитию ортостатической гипотонии и других вегетативных реакций вследствие выраженной блокады a1-адренорецепторов.
К четвертой группе относят нейролептики, сбалансированно, т. е. в одинаковой степени, блокирующие D2- И 5-НТ2а-рецепторы (последние в несколько большей степени) и в умеренной степени - а1-адренорецепторы. К данной группе относят представителей нового поколения атипичных антипсихотиков (рисперидон, зипрасидон, сертиндол), имеющих различную химическую структуру. Нейрохимический механизм действия определяет их избирательное влияние прежде всего на мезолимбические и мезокортикальные области мозга. Наряду с отчётливым антипсихотическим эффектом, отсутствием или слабой выраженностью экстрапирамидных побочных явлений (при применении терапевтических доз), слабой или умеренной пролактинемией и умеренными адренолитическими свойствами (гипотензивные реакции) эта группа нейролептиков способна корригировать негативную симптоматику путём опосредованной стимуляции дофаминергической передачи в коре мозга.
Пятую группу составляют поливалентные атипичные антипсихотики трициклической дибензодиазепиновой или близкой к ней структуры (клозапин, оланзапин и кветиапин). Так же, как и препараты третьей группы, они недифференцированно блокируют большинство нейрорецепторов. Однако 5-НТ2а-рецепторы блокируются сильнее, чем D2- и D4-рецепторы, особенно расположенные в нигростриальной области. Это определяет фактическое отсутствие или слабое экстрапирамидное действие и отсутствие связанных с усилением выработки пролактина нейроэндокринных побочных явлений при отчётливом антипсихотическом эффекте и способности уменьшать выраженность негативной симптоматики. Кроме того, все препараты этой группы обладают выраженными адренолитическими и антигистаминными свойствами, что определяет седативный и гипотензивный эффекты. Клозапин и оланзапин оказывают достаточно выраженное блокирующее влияние также на мускариновые рецепторы и приводят к развитию холинолитических побочных эффектов.
Таким образом, способность блокировать постсинаптические дофаминергические рецепторы с компенсаторным усилением синтеза и метаболизма дофамина - единственное общее биохимическое свойство для всех нейролептиков, рассмотренных в данных группах.
Шестая группа включает пока единственный атипичный антипсихотик арипипразол, который сравнительно недавно появился на отечественном психофар макологическом рынке. Этот препарат - частичный агонист D2-дофаминовых рецепторов, причём выступает в роли функционального антагониста при гипердофаминергическом состоянии и в роли функционального агониста при гиподофаминергическом профиле. Такой уникальный рецепторный профиль арипипразола делает возможным снизить риск появления экстрапирамидных расстройств и гиперпролактинемии при его применении. Кроме того, арипипразол выступает в роли частичного агониста 5-НТ1а-рецепторов и одновременно он же антагонист 5-НТ2а-рецепторов. Предполагают, что подобное взаимодействие с рецепторами ведёт в целом к сбалансированному функционированию серотониновой и дофаминовой систем, поэтому механизм действия арипипразола можно обозначить как стабилизирующий дофаминово-серотониновую систему.
Таким образом, современный уровень знаний о нейрохимических механизмах действия нейролептиков позволяет предложить новую, патогенетически более обоснованную фармакодинамическую классификацию данной группы психотропных средств. Применение этой классификации позволяет в значительной степени прогнозировать спектр психотропной активности, переносимость и вероятные лекарственные взаимодействия того или иного лекарственного средства. Другими словами, особенности нейрохимической активности препарата в значительной мере определяют особенности его клинической активности, которыми следует руководствоваться при выборе того или иного антипсихотического лекарственного средства для конкретного больного.
Эффективность глобального антипсихотического воздействия любого нейролептика оценивают с помощью так называемого хлорпромазинового эквивалента, который принимают за 1. Например, хлорпромазиновый эквивалент галоперидола = 50. Это означает, что антипсихотическая эффективность 1 мг галоперидола сравнима с 50 мг хлорпромазина. На основе этого показателя разработана классификация, которая предусматривает выделение нейролептиков, обладающих высокой (хлорпромазиновый эквивалент > 10,0), средней (хлорпромазиновый эквивалент = 1,0-10,0) и низкой (хлорпромазиновый эквивалент = 1,0) антипсихотической активностью, называемой патентностью. Типичные нейролептики (антипсихотики первого поколения) на протяжении почти полувека широко использовались в клинической психофармакотерапии. Спектр их терапевтической активности включает:
- глобальное антипсихотическое действие в виде способности равномерно и дифференцировано редуцировать различные проявления психоза:
- первичное седативное (затормаживающее) действие - способность препаратов быстро купировать психомоторное возбуждение;
- селективное, избирательное антипсихотическое действие, проявляющееся в способности воздействовать на отдельные симптомы: бред, галлюцинации, расторможенность влечений и др.;
- активирующее (растормаживающее, дезингибирующее, антиаутическое) нейротропное действие, проявляющееся развитием экстрапирамидной симптоматики;
- соматотропное действие в виде развития нейроэндокринных и вегетативных побочныйэффектов;
- депрессорное действие, выражающееся в способности некоторых антипсихотиков вызывать депрессивную симптоматику.
Многократно доказана и невспорима эффективность антипсихотиков первого поколения при лечении не только психотических расстройств, но и нарушений в рамках пограничной психиатрии. Поэтому, несмотря на большую частоту побочных эффектов терапии при их назначении, их продолжают использовать во врачебной практике.
Атипичные антипсихотики
Современные руководства содержат данные о преимуществах применения в фармакотерапии второй генерации антипсихотических средств. Сам термин "атипичные" (синоним - антипсихотики второго поколения) условен и используют его главным образом для удобства обозначения новой генерации. Препараты этой группы по сравнению с традиционными нейролептиками более эффективны при коррекции негативных, аффективных и когнитивных расстройств, что сочетается с лучшей переносимостью и меньшим риском возникновения экстрапирамидной симптоматики. Различия в характере терапевтического эффекта того или иного средства из ряда атипичных антипсихотиков объясняют, как и в группе типичных нейролептиков, его индивидуальным профилем фармакологического воздействия.
Для уточнения возможностей психофармакотерапии атипичными антипсихотиками целесообразно остановиться на препаратах этой группы, зарегистрированных в России.
 [39], [40], [41], [42], [43], [44], [45], [46], [47], [48], [49], [50],
[39], [40], [41], [42], [43], [44], [45], [46], [47], [48], [49], [50],
Клозапин (дибензодиазепин)
Родоначальник группы атипичных антипсихотиков. Механизм действия клозапина характеризуется незначительной блокадой D2-рецепторов с одновременно высоким антагонизмом к 5-НТ2а-рецепторам, a1, а2-адренергическим и Н1-гистаминовым рецепторам. Он зарекомендовал себя как эффективное антипсихотическое средство в случаях резистентности к другим антипсихотикам (препарат группы резерва), а также показан для лечения хронических маний, психотического возбуждения, агрессии. В отечественной практике клозапин довольно часто назначают для достижения седации и в качестве снотворного средства у психотических больных. Следует признать, что подобное применение клозапина не соответствует его основному профилю показаний для использования в терапии. Вероятно, следует пересмотреть отношение к этому антипсихотику как к препарату второстепенного значения, поскольку на сегодняшний день он - единственное средство с доказанной эффективностью у резистентных больных.
Клозапин, в отличие от типичных нейролептиков, не вызывает серьёзных экстапирамидных расстройств ввиду отмеченного выше низкого аффинитета к 02-рецепторам. Оказалось также, что его можно использовать для лечения поздней дистонии и тяжёлой акатизии. Ввиду малого риска развития ЗНС клозапин можно рассматривать как препарат выбора у больных, ранее перенёсших это осложнение.
Тем не менее при терапии клозапином возможно развитие ряда серьёзных побочных эффектов. Самое опасное из них (даже при назначении небольших доз) - агранулоцитоз, возникающий у 0,5-1,0% больных. Среди других важных побочных эффектов, возможных при использовании препарата, нужно отметить сонливость, гиперсаливацию и увеличение массы тела, которая нередко бывает повышена уже к моменту назначения клозапина под влиянием предшествующей антипсихотической терапии. Следует также обратить внимание на возможность развития при его приёме тахикардии, артериальной гипотензии и эпилептических припадков. Вероятность, возникновения припадков зависит от дозы. Их риск существенно возрастает, если доза клозапина превышает 600 мг/сут. Развитие припадков - не противопоказание для дальнейшего приёма препарата, но требует половинного уменьшения дозы и назначения противосудорожных средств, таких, как вальпроевая кислота. Профилактика побочных эффектов лечения клозапином включает тщательный мониторинг картины белой крови, а также ЭКГ и эндокринных показателей.
При передозировке клозапина возможны угнетение сознания вплоть до развития комы, а также симптомы, связанные с холинолитическим эффектом (тахикардия, делирий), эпилептические припадки, угнетение дыхания, экстрапирамидные синдромы. Летальный исход может наступить при приёме дозы, превышающей 2500 мг препарата.
 [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [62], [63], [64], [65], [66]
[51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [62], [63], [64], [65], [66]
Рисперидон
Производное бензизоксазола с высоким сродством к серотониновым и дофаминовым Dj-рецепторам с преимущественным воздействием на серотониновую систему. Препарат имеет широкие показания для применения, включая купирование обострений, противорецидивное лечение, терапию первого психоти-ческого эпизода, коррекции негативных симптомов шизофрении. Отмечена способность препарата улучшать когнитивное функционирование больных шизофренией. Получены предварительные данные о том, что рисперидон редуцирует также коморбидные аффективные симптомы у больных шизофренией и может быть препаратом выбора в терапии биполярных аффективных расстройств.
Побочные эффекты терапии рисперидоном, прежде всего экстрапирамидные расстройства, дозозависимы и чаще возникают при дозе, превышающей 6 мг/сут. Другие побочные эффекты включают тошноту, рвоту, тревогу, сонливость, повышение уровня пролактина в сыворотке крови. Длительный приём рисперидона может приводить к увеличению массы тела и развитию сахарного диабета 2-го типа, но с меньшей вероятностью по сравнению с клозапином, оланзапином.
При передозировке возможны сомноленция, эпилептические припадки, удлинение интервала Q-T и расширение комплекса QRS, артериальная гипотензия. Описаны случаи летального исхода при передозировке рисперидона.
Несомненное достоинство препарата - наличие жидкой и быстрорастворимой (сублингвальной) форм, использование которых ускоряет поступление препарата в организм больного и облегчает контроль за его приёмом. Существует также пролонгированная форма препарата - порошок для приготовления суспензии для внутримышечного введения (конста-рисперидон в микросферах). Она рекомендована для проведения поддерживающего лечения больных шизофренией, особенно для пациентов с плохим комплайенсом. Необходимо учитывать тот факт, что для попадания в кровоток препарату необходимо около трёх недель, поэтому при начале терапии конста-рисперидоном пациент должен дополнительно принимать пероральную форму рисперидона на протяжении как минимум 3 нед после первой инъекции.
Оланзапин
По фармакологическому действию близок к клозапину, поскольку обладает плейоморфным рецепторным профилем со значительным аффинитетом к серотониновым, мускариновым, а1-адренергическим, гистаминовым рецепторам. Терапевтическая активность оланзапина имеет черты сходства с эффективностью клозапина и рисперидона в отношении воздействия на позитивные, негативные и депрессивные симптомы шизофрении. Вместе с тем получены данные о большей эффективности оланзапина по сравнению с другими атипичными антипсихотиками у больных с первым психотическим эпизодом и при коррекции показателей когнитивного функционирования. Следует учитывать, что в начале терапии с использованием таблетированной формы препарата возможно быстрое появление дезингибирующего эффекта с усилением психомоторного возбуждения и тревоги. Поэтому в терапии приступов, сопрождающихся выраженным психомоторным возбуждением, показано применение инъекционной формы препарата.
Оланзапин редко вызывает экстрапирамидные расстройства или позднюю дискинезию, а наиболее частые побочные эффекты при его использовании - метаболические расстройства и увеличение массы тела. Установлено, что у пациентов, получающих оланзапин, достаточно часто повышаются уровни холестерина, липидов плазмы и возникает предрасположенность к сахарному диабету 2-го типа, однако подобные эффекты встречались одинаково часто у пациентов, получающих как оланзапин, так и клозапин. Вместе с тем получены данные о том, что повышение массы тела корреллирует с положительным ответом на приём оланзапина (т.е. служит важным прогностическим показателем терапии), а перерастает в ожирение - только у 20-30% больных, набравших избыточную массу тела в процессе лечения.
При передозировке возможны седативный эффект, токсическое холинолитическое действие, эпилептические припадки, артериальная гипотензия. К настощему времени отсутствуют убедительные данные, чтобы оценить опасность летального исхода при передозировке препарата.
Кветиапин
Относят к дибензотиазепиновым соединениям. Его рецепторный профиль во многом сходен с таковым у клозапина. Уровень связывания кветиапина с D2-рецепторами низкий (менее 50%) и кратковременный даже при применении высоких его доз. Препарат эффективен для лечения позитивных, негативных и общих симптомов шизофрении. Существуют данные об успешном его применении как в случаях высокой резистентности к терапии, так и для улучшения показателей когнитивного функционирования больных, что даёт право рекомендовать его как антипсихотик первой линии для поддерживающей терапии шизофрении. Наконец, кветиапин обладает умеренно антидепрессивным, активирующим эффектом. Поэтому он показан в терапии депрессивно-бредовых приступов и расстройств сенесто-ипохондрического круга.
Установленная высокая тимотропная активность кветиапина объясняет тот факт, что он зарегистрирован как средство для купирования и вторичной профилактики депрессивных расстройств. Для лечения маниакальных эпизодов в рамках биполярных расстройств I и II типа кветиапин применяют в качестве дополнительного средства. Отсутствие инъекционных форм несколько лимитирует его использование у пациентов с наличием возбуждения и агрессивным поведением.
Кветиапин имеет достаточно хорошую переносимость, он практически не вызывает экстрапирамидные синдромы, за исключением случаев, когда применяют максимальные дозы. Кветиапин не вызывает гиперпролактинемии, реже, чем оланзапин и клозапин, приводит к увеличению массы тела и нарушению толерантности к глюкозе.
Зипрасидон
Обладает уникальным профилем рецепторной активности. Будучи мощным антагонистом 5HТ2а-рецепторов и D2-рецепторов, он также является активным ингибитором обратного захвата серотонина и норадреналина. Клинические исследования продемонстрировали значимое превосходство зипрасидона по его воздействию на психотические симптомы и проявления агрессии по сравнению с галоперидолом. Также получены данные о положительном влиянии зипразидона на когнитивные функции больных шизофренией, равно как и на коморбидные аффективные симптомы, показатели социального функционирования. Зипрасидон обычно хорошо переносится и крайне редко вызывает экстрапирамидные синдромы, увеличение массы тела и метаболические нарушения. Чаще возникает удлинение интервала Q-T свыше 460 мс, поэтому больным, получающим этот препарат, целесообразно проводить ЭКГ-исследование как до назначения препарата, так и контрольное мониторирование в процессе лечения. Следует обращать особое внимание на сопутствующую терапию (приём антиаритмических средств), способную усугубить удлинение интервала Q-T и привести к возникновению сердечной аритмии, фибрилляции желудочков.
Сертиндол
Относят к дериватам фенилиндола. Он обладает высоким функциональным антагонизмом по отношению к D2-, серотониновым (особенно 5-НТ2а-рецепторов) и а1-адренергическим рецепторам. По данным электронейрохимических исследований, сертиндол избирательно ингибирует дофаминовые рецепторы в вентральном сегментарном регионе. Такая селективность, по всей вероятности, обеспечивает низкий риск возникновения экстрапирамидных синдромов и гиперпролактинемии при применении препарата. Результаты сравнительных исследований показали, что по показателю антипсихотической активности сертиндол сопоставим с галоперидолом. Препарат обладает выраженным дезингибирующим эффектом у больных с негативной и депрессивной симптоматикой, который превосходит подобный эффект рисполепта. Существуют данные, подтверждающие также эффективность сертиндола для коррекции когнитивных нарушений у больных шизофренией. Сертиндол, как правило, хорошо переносится больными, редко вызывает седацию н поэтому рекомендован как препарат замены при возникновении побочных эффектов в процессе терапии другими современными антипсихотиками.
Из числа серьёзных побочных эффектов отмечена способность препарата удлинять интервал Q-Т, что может привести к сердечной аритмии. При анализе постмаркетинговых исследований стало очевидно, что кардиологический профиль сертиндола не отличается от такового у других антипсихотиков нового поколения.
Арипипразол
Обладает сопоставимой с другими атипичными средствами антипсихотической активностью, но при этом оказывает большее воздействие на параметры когнитивного функционирования больных шизофренией. Отмеченное выше уникальное фармакологическое действие препарата - частичный агонист D2-рецепторов - позволяет снизить риск появления экстрапирамидных синдромов и гиперпролактинемии при его применении.
 [67], [68], [69], [70], [71], [72], [73], [74], [75], [76]
[67], [68], [69], [70], [71], [72], [73], [74], [75], [76]
Амисульприд
Относят к классу замещённых бензамидов. Препарат селективно связывается с подтипами D2- и D3-дофаминергических рецепторов, не обладает сродством к подтипам D1-, D4- и D5-, а также к серотониновым, Н1-гистаминовым, а1-адренергическим и холинергическим рецепторам. При использовании в высоких дозах он блокирует постсинаптпческие D2-рецепторы. В низких дозах проявляется его дезингибирующий эффект за счёт блокады пресинаптических D2-, D3-рецепторов, в связи с чем его применение также эффективно при лечении негативных симптомов, хотя он - не комбинированный антагонист D2-рецепторов и рецепторов серотонина. Результаты ряда исследований говорят о выраженной антипсихотической активности препарата при применении высоких доз, которая превосходит традиционные препараты.
 [77], [78], [79], [80], [81], [82], [83], [84], [85], [86], [87]
[77], [78], [79], [80], [81], [82], [83], [84], [85], [86], [87]
Побочные эффекты терапии антипсихотиками
В таблице приведены основные побочные эффекты терапии атипичным антипсихотиками.
|
Препарат |
Экстра-пирамидные |
Нарушение проводимости на ЭКГ |
Метаболические расстройства (увеличение массы тела, повышение содержания глюкозы, холестерина, триглицеридов в крови) |
||
|
Клозапин |
. |
++ |
++ |
++- |
|
|
Рисперидон |
++ |
+/- |
++ |
+/- |
|
|
Оланзапин |
+ |
+/- |
+++ |
++ |
+++ |
|
Кветиапин |
+/- |
+ |
+/- |
--- |
|
|
Зипрасидон |
+ |
++ |
+/- |
+/- |
+/- |
|
Сертиндол |
++ |
-- |
+/- |
-- |
|
|
Арилипразол |
-- |
--- |
+/- |
-- |
-- |
|
Амисульприд |
++ |
+/- |
|||
Примечание. Выраженность побочных эффектов: "+++" - высокая: "++" - средняя; «+» - низкая; "+/-" - сомнительная; "-" - отсутствует.
Экстрапирамидные синдромы
Одна из основных особенностей атипичных антипсихотиков, в отличие от традиционных, их низкая способность вызывать экстрапирамидные синдромы, что и стало прорывом в поддерживающей фармакотерапии шизофрении. Однако, как следует из данных таблицы, при применении отдельных препаратов этого ряда (рисперидон, амисульприд) такие симптомы могут возникать, что требует при их назначении особого внимания.
 [5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17]
[5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17]
Нарушения на ЭКГ
Возможность развития кардиологических побочных эффектов - серьёзная проблема при использовании в терапии некоторых современных антипсихотиков. В этих случаях речь идёт об удлинении интервала Q-Т, что может приводить к возникновению аритмии. Нарушение проводимости, в первую очередь удлинение интервала Q-Т, наиболее часто наблюдают при лечении клозапином, сертиндолом, зипрасидоном. Сопутствующая патология в виде брадикардии, атриовентрикулярной блокады, гипотиреоза может способствовать появлению данного осложнения при терапии вышеуказанными препаратами. В настоящее время рекомендуют мониторирование ЭКГ приблизительно раз в 3 мес у пациентов, получающих поддерживающую терапию атипичными антипсихотиками.
 [18], [19], [20], [21], [22], [23]
[18], [19], [20], [21], [22], [23]
Эндокринные нарушения
В настоящее время наибольшую озабоченность вызывает способность атипических антипсихотических препаратов вызывать увеличение массы тела. Повышение массы тела, содержания глюкозы, триглицеридов в крови могут привести к нарушению обмена веществ и развитию диабета 2-го типа. Особенно необходима осторожность и проведение еженедельного контроля биохимических показателей при терапии клозапином и оланзапином. По мнению J. Geddes et al. (2000), Р.В. Jones, P.F. Buckley (2006), следует признать целесообразным проведение тщательного обследования пациентов перед назначением им того или иного антипсихотика современной генерации, поскольку известно, что метаболические нарушения чаще возникают у больных, имевших наследственную предрасположенность, избыточную массу тела, нарушения липидного спектра и гипергликемию до начала лечения. Алгоритм мониторинга, предложенного P. В. Jones, P.F. Buckley (2006), включает несколько пунктов.
- Сбор анамнеза и семейных факторов в отношении риска метаболических нарушений.
- Регистрацию индекса массы тела, ЭКГ, АД и пульса до начала лечения.
- Сбор лабораторных данных (глюкоза, липидный спектр, холестерин) до начала терапии.
- Регулярный контроль индекса массы тела, витальных показателей во время лечения.
- Контроль лабораторных данных во время лечения.
Появление гиперпролактинемии при терапии антипсихотиками обусловлено центральной блокадой дофаминовых рецепторов в гипоталамусе, что приводит к высвобождению пролактина передней доли гипофиза. Наиболее часто гиперпролактинемия возникает при лечении оланзапином, рисперидоном и амисульпридом.
Агранулоцитоз
Ещё одно серьёзное осложнение антипсихотической терапии. Он может наблюдаться при лечении клозапином и оланзапином. По данным J. Geddes et al. (2000), он диагностировался в течение первых 3 мес у 1-2% больных, принимавших эти препараты. В связи с этим рекомендуют еженедельный анализ крови у больных, принимающих эти средства, в течение первых 18 нед терапии и ежемесячный контроль в дальнейшем. Показано, что при снижении дозы вышеуказанных нейролептиков клинический анализ крови вновь возвращался к норме. Вместе с тем следует признать, что на сегодняшний день нет чёткой стратегии в отношении пациентов, у которых возникают приведённые побочные эффекты, связанные с нарушением метаболизма. Наиболее часто заменяют один атипичный антипсихотик на другой. Другим перспективным направлением следует признать назначение специальной коррегирующей терапии, в частности применение препарата бромокриптина для коррекции гиперпролактинемии. Идеальной следует считать ситуацию, при которой курацию больного с такими расстройствами осуществляют с периодическим привлечением интернистов, в частности эндокринологов, кардиологов и других специалистов.
В заключение следует отметить, что при соблюдении приведённых алгоритмов назначения и мониторинга не только психического, но и физического состояния пациентов применение препаратов второй генерации является более безопасным, чем типичных нейролептиков.
В настоящее время стадию разработки проходят ещё целый ряд антипсихотиков. Препараты следующего поколения, вероятно, будут обладать иным механизмом действия (например, иметь ГАМК-ергический профиль) и окажутся способными влиять на различные проявления шизофрении, в том числе на собственно дефицитарные расстройства.
Внимание!
Для простоты восприятия информации, данная инструкция по применению препарата "Нейролептики, или антипсихотики " переведена и изложена в особой форме на основании официальной инструкции по медицинскому применению препарата. Перед применением ознакомьтесь с аннотацией, прилагающейся непосредственно к медицинскому препарату.
Описание предоставлено с ознакомительной целью и не является руководством к самолечению. Необходимость применения данного препарата, назначение схемы лечения, способов и дозы применения препарата определяется исключительно Лечащим врачом. Самолечение опасно для Вашего здоровья.

