Медицинский эксперт статьи
Новые публикации
Артериовенозная мальформация
Последняя редакция: 04.12.2023

Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
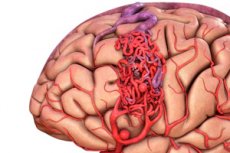
Артериовенозная мальформация - врожденный дефект развитии сосудов, который характеризуется наличием аномальной сетки артериовенозных анастомозов. Наиболее часто артериовенозная мальформация расположены в области задней черепной ямки и имеют довольно типичное строение - одна-две настоящих артерии, клубок АВМ и одна дренирующая вена.
Причины артериовенозной мальформации
Причины, которые могут лежать в основе развития АВМ, до конца не изучены, но считается, что они могут быть связаны с генетическими и окружающими факторами. Вот некоторые из возможных причин, которые могут быть ассоциированы с развитием АВМ:
- Генетические факторы: Исследования показали, что у некоторых пациентов с АВМ имеются семейные предрасположенности к этому состоянию. Генетические мутации могут играть роль в формировании аномалии сосудов.
- Врожденные дефекты: Врожденные аномалии сосудов могут развиваться во время эмбрионального развития. Это может быть связано с ошибками в развитии сосудистых тканей мозга.
- Окружающие факторы: Некоторые исследования показали связь между АВМ и некоторыми окружающими факторами, такими как излучение или токсические воздействия на беременность. Однако эти связи не всегда подтверждаются и не объясняют все случаи АВМ.
- Региональные факторы: В некоторых случаях АВМ может быть ассоциирована с определенными географическими областями или этническими группами, но эти связи требуют дополнительных исследований.
Помимо этих факторов, которые могут повлиять на развитие АВМ, важно отметить, что это врожденное состояние, и оно обычно обнаруживается с рождения или в раннем детстве, хотя симптомы могут проявиться и в более позднем возрасте. Для точного понимания причин и механизмов развития АВМ требуются дальнейшие исследования.
Патогенез
Наиболее опасным является разрыв стенок мальформации, что сопровождается спонтанным внутричерепным кровоизлиянием. Происходит это вследствие того, что в сосудах мальформации циркулирует смешанная кровь под давлением, близким к артериальному. И естественно, что высокое давление приводит к растяжению дегенеративно измененных сосудов, увеличению их объема и истончению стенки. В конечном итоге в наиболее истонченном месте возникает разрыв. По статическим данным это происходит у 42-60% больных с АВМ. Летальность при первом разрыве АВМ достигает 12-15%. У остальных кровотечения могут повторяться, без какой-либо периодичности. Мы наблюдали больную, у которой в течение 8 лет было одиннадцать спонтанных внутричерепных кровоизлияний. Такое, относительно "доброкачественное" течение разрыва АВМ по сравнению с разрывом артериальных аневризм объясняется особенностями гемодинамических нарушений, возникающих вслед за разрывом. Известно, что разрыв артериальной аневризмы приводит чаще всего к субарахноидальному кровоизлиянию (САК) и развитию ангиоспазма, который в первые минуты носит защитный характер, способствуя быстрой остановке кровотечения, но в последующем представляет основную опасность для жизни больного.
Именно ангиоспазм, приводящий к ишемизации мозга и его отеку, и определяет тяжесть состояния больного и прогноз. В отличие от этого, ангиоспазм приводящих артерий АВМ, наоборот, улучшает кровоснабжение мозга вследствие уменьшения артериовенозного сброса. При разрыве АВМ чаще формируются внутримозговые и субдуральные гематомы. Прорыв крови в субарахноидальные цистерны вторичен. Кровотечение из разорвавшейся стенки АВМ быстрее останавливается, т.к. давление крови в ней ниже, чем в магистральных артериях и стенка более податлива к сдавлению излившейся кровью. Естественно, что это не всегда завершается благополучно для больного. Наиболее опасны разрывы АВМ вблизи желудочков мозга, в подкорковых ганглиях и в стволе мозга. Ангиоспазм приводящих артерий в данной ситуации способствует остановке кровотечения.
Определяющим фактором в патогенезе разрыва АВМ является объем излившейся крови и локализация гематомы. Полушарные внутримозговые гематомы даже объемом до 60 см3 протекают относительно благоприятно. Они могут вызывать грубые очаговые неврологические нарушения, но при этом редко приводят к грубым витальным расстройствам. Прорыв гематомы в желудочки мозга в значительной степени ухудшает прогноз. С одной стороны, кровь, раздражая эпендиму желудочков, усиливает ликворопродукцию, с другой стороны, воздействуя на дно желудочка, приводит к грубым расстройствам функций жизненно важных центров, расположенных в гипоталамусе. Распространение крови по всей желудочковой системе приводит к тампонаде последней, что само по себе не совместимо с жизнью.
Кровь, проникшая в субарахноидальные цистерны, так же нарушает ликвороциркуляцию, затрудняя доступ ликвора к блокированным кровью пахионовым грануляциям. Вследствие этого замедляется резорбция ликвора и может развиваться острая ликворная гипертензия, а затем внутренняя и наружная гидроцефалия. В результате распада форменных элементов излившейся крови образуется большое количество токсических веществ, большинство из которых имеют вазоактивное действие. Это, с одной стороны, приводит к вазоконстрикции мелких пиальных артерий, с другой - повышает проницаемость капилляров. Продукты распада крови так же воздействуют на нервные клетки, изменяя в них биохимические процессы и нарушая проницаемость клеточных мембран. Прежде всего, изменяется функция калиево-натриевого насоса и калий начинает покидать клетку, а на его место устремляется катион натрия, который в четыре раза более гидрофильный, чем калий.
Это приводит вначале к внутриклеточному отеку в зоне вокруг кровоизлияния, а затем и к набуханию клеток. Развитию отека способствует также гипоксия, которая неизбежно присоединяется вследствие сдавления сосудов мозга гематомой и повышенным ликворным давлением, о чем уже было сказано. Нарушение функций диэнцефальных отделов мозга и, прежде всего, регуляции водно-электролитного баланса приводит к задержке в организме жидкости, потери калия, что также усиливает отечную реакцию мозга. Патогенез разрыва АВМ не ограничивается только церебральными нарушениями. Не менее опасны и внецеребральные осложнения. Прежде всего, это церебро-кардиальный синдром, который на электрокардиограмме может симулировать острую коронарную недостаточность.
Довольно быстро у больных с внутримозговыми кровоизлияниями развивается пневмония и дыхательная недостаточность. Причем, бактериальная флора при этом играет вторичную роль. Первичным является центральное влияние на легкие, заключающееся в распространенном бронхоспазме, усилении продукции мокроты и слизи, ишемии легочной паренхимы вследствие распространенного спазма мелких легочных артерий, что быстро приводит к дистрофическим расстройствам, десквамации альвеолярного эпителия, снижению газа обменной функции легких.
Если к этому присоединяется угнетение кашлевого рефлекса, бульбарный тип нарушения дыхания, то возникает серьезная угроза жизни больного. В большинстве случаев следующий за этим гнойный трахиобронхит плохо поддается антибактериальной терапии и усугубляет дыхательную недостаточность, что незамедлительно сказывается на усилении гипоксии мозга. Таким образом, нарушение внешнего дыхания даже при относительной компенсации церебральных нарушений может привести к летальному исходу. Нередко больные после комы приходят в сознание, но затем умирают от нарастающей дыхательной недостаточности и гипоксического отека мозга.
Дистрофические изменения быстро развиваются не только в легких, но и в печени, желудочном тракте, в надпочечниках и почках. Угрозу для жизни больного представляет мочевая инфекция и пролежни, быстро развивающиеся при отсутствии хорошего ухода за больным. Но этих осложнений можно избежать, если врачи о них помнят и знают методы борьбы с ними.
Подводя итог рассмотрению патогенеза разрыва АВМ, следует подчеркнуть, что смертность при таких внутричерепных кровоизлияниях ниже, чем при разрыве артериальных аневризм и гипертонических геморрагических инсультах, хотя и достигает цифры 12-15%. Для АВМ характерны повторные, иногда многократные кровоизлияния с различной периодичностью, которую невозможно предугадать. При неблагоприятном течении постгеморрагического периода перечисленные патогенетические механизмы могут привести к летальному исходу.
Симптомы артериовенозной мальформации
Геморрагический тип течения заболевания (50-70 % случаев). Для этого типа характерны наличие у больного артериальной гипертензии, небольшой размер узла мальформации, дренаж ее в глубокие вены, достаточно часто встречаются артериовенозная мальформация задней черепной ямки.
Геморрагический тип в 50 % случаев является первым симптомом проявления артериовенозной мальформации, обусловливает детальный результат и 10-15 % и инвалидизацию 20-30 % больных (N. Martin et el.). Ежегодный риск кровоизлияния у больных с артериовенозной мальформацией составляет 1,5-3 %. Риск повторного кровоизлияния в течение первого года достигает 8 % и увеличивается с возрастом. Кровотечение из артериовенозной мальформации является причиной 5-12 % всей материнской смертности и 23 % всех внутричерепных кровоизлияний у беременных. Картина субарахноидального кровотечения наблюдается у 52 % больных. У 17 % пациентов возникают осложненные формы кровоизлияния: сформированием внутримозговых (38 %), субдуральных (2 %)я смешанных (13 %) гематом, гемотампонада желудочков развивается в 47 %.
Торпидный тип течения характерен для больных с артериовенозной мальформацией больших размеров, локализацией ее в коре. Кровоснабжение артериовенозной мальформации осуществляется ветвями средней мозговой артерии.
Для торпидного типа течения наиболее характерны судорожный синдром (у 26-27 % больных с артериовенозной мальформацией), кластерные головные боли, прогрессирующий неврологический дефицит, как и при опухолях головного мозга.
Варианты клинического проявления артериовенозных мальформаций
Как уже указывалось, наиболее частым первым клиническим проявлением АВМ является спонтанное внутричерепное кровоизлияние (40-60% больных). Возникает оно чаще без каких-либо предвестников, среди полного здоровья. Провоцирующими моментами могут быть физическая нагрузка, стрессовая ситуация, нервно-психическое напряжение, прием больших доз алкоголя и др. В момент разрыва АВМ больные ощущают внезапную резкую головную боль, по типу удара или разрыва. Боль быстро нарастает, вызывая головокружение, тошноту и рвоту.

В течение нескольких минут может наступить потеря сознания. В редких случаях головная боль может быть неинтенсивной, больные сознания не теряют, но ощущают, как слабеют и немеют конечности (обычно контралатеральные очагу кровоизлияния), нарушается речь. В 15% случаев кровоизлияние проявляется развернутым эпиприпадком, после которого больные могут оставаться в коматозном состоянии.
Для определения тяжести кровоизлияния из АВМ за основу можно принять приведенную выше шкалу Ханта-Хесса с некоторыми поправками. Ввиду того, что кровоизлияния из АВМ могут иметь самую различную симптоматику, очаговая неврологическая симптоматика может превалировать над общемозговой. Поэтому больные, находящиеся по уровню сознания на I или II ступенях шкалы, могут иметь грубые очаговые неврологические расстройства (гемипарезы, гемигипестезии, афазии, гемианопсии). В отличие от аневризматических кровоизлияний, при разрыве АВМ определяется не выраженностью и распространенностью ангиоспазма, а объемом и локализацией внутримозговой гематомы.
Менингеальный синдром развивается через несколько часов и выраженность его может быть различной. Артериальное давление, как правило, повышается, но не так резко и не так длительно, как при разрыве артериальных аневризм. Обычно этот подъем не превышает 30-40 мм рт. ст. На вторые-третьи сутки появляется гипертермия центрального генеза. Состояние больных закономерно ухудшается по мере нарастания отека мозга и усиления распада излившейся крови. Это продолжается до 4-5 суток. При благоприятном течении после стабилизации на 6-8-е сутки состояние больных начинает улучшаться. Динамика очаговых симптомов зависит от локализации и размера гематомы.
При кровоизлиянии в функционально важные зоны мозга или разрушении двигательных проводников симптомы выпадения появляются сразу и длительно удерживаются без какой-либо динамики. Если же симптомы выпадения появляются не сразу, а нарастают параллельно с отеком мозга, можно ожидать восстановления дефицита через 2-3 недели, когда полностью регрессирует отек.
Клиническая картина разрыва АВМ весьма разнообразна и зависит от многих факторов, главными из которых являются: объем и локализация кровоизлияния, выраженность отечной реакции мозга, степень вовлечения в процесс стволовых структур.
Артериовенозные мальформации могут проявляться эпилептиформными припадками (30-40%). Причиной их развития могут быть гемоциркуляторные нарушения в соседних областях мозга вследствие феномена обкрадывания. Кроме этого, сама мальформация может раздражающе действовать на кору головного мозга, генерируя эпиразряды. А так же мы уже говорили об отдельных видах АВМ, вокруг которых развивается глиоз мозговой ткани, что так же нередко проявляется эпиприпадками.
Для эписиндрома, обусловленного наличием АВМ, характерна беспричинность возникновения в зрелом возрасте, часто при полном отсутствии провоцирующего фактора. Припадки могут быть генерализованные или фокальные. Наличие четкого очагового компонента в эпиприпадке при отсутствии общемозговых симптомов должно натолкнуть на мысль о возможной АВМ. Даже генерализованные припадки, если начинаются с судорог преимущественно в одних и тех же конечностях с насильственным поворотом головы и глаз в ту или иную сторону часто являются проявлением АВМ. Реже у больных встречаются малые припадки типа абсансов или сумеречного сознания. Частота и периодичность эпиприпадков может быть различной: от единичных до повторяющихся.
Формы
В.В. Лебедев и соав. выделили три варианта церебро-кардиального синдрома по данным ЭКГ:
- I тип - нарушение функций автоматизма и возбудимости (синусовая тахи- или брадикардия, аритмия, мерцание предсердий);
- II тип - изменение процессов реполяризации, преходящие изменения конечной фазы желудочкового комплекса по типу ишемии, повреждения миокарда с изменением зубца Т и положения сегмента SТ;
- III тип - нарушение функций проводимости (блокада, признаки повышенной нагрузки на правые отделы сердца). Эти изменения ЭКГ могут сочетаться и выраженность их коррелирует с тяжестью общего состояния больных.
Осложнения и последствия
Артериовенозная мальформация (АВМ) представляет собой врожденную аномалию сосудов, при которой артерии и вены соединены без промежуточного капиллярного слоя. Осложнения и последствия АВМ могут быть серьезными и зависят от размера, местоположения и характеристик конкретной мальформации. Вот некоторые из них:
- Инсульт: Одним из самых серьезных осложнений АВМ является риск инсульта. Мальформации могут создавать аномальные пути для кровотока, что может привести к кровоизлияниям в мозге, вызывая инсульт. Инсульт может иметь различные степени тяжести и оставить остаточные неврологические дефициты.
- Эпилепсия: АВМ может вызывать эпилептические припадки у некоторых пациентов, особенно если мальформация расположена в определенных областях мозга.
- Геморрагия: Мальформации могут быть непредсказуемыми и вызывать кровотечения в мозге. Это может быть жизнеугрожающим осложнением и приводить к серьезным последствиям.
- Гидроцефалия: Если АВМ расположена вблизи желудочков мозга, она может вызвать гидроцефалию, что может привести к накоплению лишней жидкости в мозге и увеличению внутричерепного давления.
- Нейрологические дефициты: АВМ может повреждать окружающие ткани мозга и вызывать различные неврологические дефициты, включая паралич, нарушения чувствительности и дефициты в речи и координации движений.
- Боли и головные боли: Пациенты с АВМ могут испытывать хронические боли и головные боли, связанные с мальформацией.
- Психологические последствия: Осложнения от АВМ могут оказать серьезное воздействие на психологическое состояние пациентов, включая тревожность, депрессию и стресс.
- Ограничение в образе жизни: После обнаружения АВМ, пациентам может потребоваться изменение образа жизни и рекомендации по управлению рисками, включая ограничение физической активности и некоторых видов деятельности.
Диагностика артериовенозной мальформации
Диагностика артериовенозной мальформации (АВМ) обычно включает в себя различные методы обследования и изображения для подтверждения наличия и оценки характеристик мальформации. Вот основные методы диагностики АВМ:
- Магнитно-резонансная ангиография (МРА): МРА является одним из основных методов для диагностики АВМ. Это неинвазивное исследование, которое позволяет визуализировать структуру сосудов и поток крови в головном мозге с использованием магнитных полей и радиоволн. МРА позволяет определить местоположение, размер и форму АВМ.
- Цифровая субтракционная ангиография (DSA): Это более инвазивный метод, при котором внедряется контрастное вещество непосредственно в сосуды через катетер, и проводится рентгеновская процедура для получения высококачественных изображений сосудов головного мозга. DSA позволяет более подробно изучить структуру АВМ и определить особенности кровотока.
- Компьютерная томография (КТ): КТ может быть использована для обнаружения АВМ и оценки возможных осложнений, таких как кровоизлияния. При необходимости может применяться контрастное вещество для улучшения визуализации.
- Дуплексное сканирование сосудов (дуплексное УЗИ): Этот метод может быть полезен для исследования сосудов шеи и головы и определения нарушений кровотока, связанных с АВМ.
- Магнитно-резонансная спектроскопия (MRS): MRS может предоставить информацию о химическом составе тканей в зоне АВМ и выявить признаки изменений метаболизма.
- Эхоэнцефалография: Это ультразвуковое исследование, которое может быть использовано для оценки кровотока и структуры мозга.
- Ангиография с использованием томографии (CTA): CTA объединяет КТ и ангиографию, позволяя получить трехмерные изображения сосудов головного мозга.
После диагностики АВМ важно провести детальную оценку характеристик мальформации, таких как ее размер, форма и степень опасности. Это поможет определить, нужно ли лечение, и выбрать наилучший метод лечения, включая хирургическое удаление, эмболизацию, лучевую терапию или наблюдение. Решение о лечении АВМ должно быть вынесено совместно между пациентом и медицинской командой, учитывая индивидуальные особенности каждого случая.
Дифференциальная диагностика
Дифференциальная диагностика артериовенозной мальформации (АВМ) может быть важным этапом при обследовании пациента с сосудистыми изменениями в мозге. АВМ представляют собой аномалию сосудов, при которой артерии и вены соединены без промежуточного капиллярного слоя. Они могут вызывать разнообразные симптомы и состояния, и их дифференциация от других сосудистых нарушений важна для правильного лечения. Вот некоторые состояния, которые могут потребовать дифференциальной диагностики с АВМ:
- Инсульт: Инсульты могут имитировать симптомы АВМ, особенно если инсульт вызван сосудистыми изменениями. Различие может потребовать компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) мозга для визуализации сосудистых изменений.
- Гематома: Гематомы, такие как субдуральная или эпидуральная гематома, могут имитировать симптомы АВМ, особенно если сопровождаются головной болью и неврологическими симптомами. КТ или МРТ могут помочь в определении причины симптомов.
- Опухоли мозга: Опухоли мозга могут вызывать разнообразные симптомы, которые могут быть похожи на симптомы АВМ. Диагностика может включать в себя МРТ с контрастным веществом и другие образовательные методы.
- Мигрень: Мигрени с аурой могут имитировать симптомы АВМ, такие как зрительные нарушения и головокружение. Анамнез и дополнительные обследования могут помочь различить их.
- Васкулиты мозга: Васкулиты могут вызывать воспаление сосудов и сосудистые нарушения, которые могут быть похожи на симптомы АВМ. Биопсия или ангиография могут использоваться для диагностики васкулитов.
- Венозная тромбоз: Венозные тромбозы могут имитировать симптомы АВМ, особенно если есть нарушение венозного оттока из мозга. Дополнительные исследования могут помочь в выявлении тромбоза.
Для точной дифференциальной диагностики АВМ исследование включает в себя обширное клиническое обследование, нейрообразовательные методы (КТ, МРТ, ангиография), иногда биопсию и другие специализированные процедуры в зависимости от конкретных симптомов и обстоятельств.
К кому обратиться?
Лечение артериовенозной мальформации
Лечение артериовенозной мальформации (АВМ) зависит от ее размеров, местоположения, симптомов и потенциальных осложнений. В некоторых случаях, АВМ может быть небольшой и бессимптомной, и не требует активного лечения. Однако при наличии симптомов или риска кровоизлияния, лечение может быть необходимо. Вот некоторые из методов лечения АВМ:
- Хирургическое вмешательство: Хирургическое удаление АВМ может быть рассмотрено в тех случаях, когда мальформация находится в доступном месте и имеет низкую степень сложности. Хирургическое удаление может помочь предотвратить риск кровоизлияния и снизить симптомы. Это сложная процедура, и она может быть связана с рисками, такими как повреждение окружающих тканей и нервов.
Открытые (транскраниальные) вмешательства:
- I этап - коагуляция афферентов;
- II этап - выделение ядра артериовенозной мальформации;
- III этап - перевязывание и коагуляция эфферентой и удаление артериовенозной мальформации,
Эндоваскулярные вмешательства:
- стационарная баллон-окклюзия питающих артерий - эмболизация в потоке (неуправляемая);
- комбинация временной или постоянной баллон-окклюзии с эмболизацией в потоке;
- суперселективная эмболизация.
Артериовенозная мальформация также лечится с помощью радиохирургии (Gamma-knife, Cyber-knife, Li nас и др.).
- Эмболизация: Эмболизация - это процедура, при которой внедряются медицинские материалы или клей в сосуды, чтобы заблокировать кровообращение в АВМ. Эмболизация может быть использована в качестве подготовительного этапа перед хирургическим вмешательством или как самостоятельное лечение. Это может помочь уменьшить кровотечение и размеры АВМ.
- Лучевая терапия: Лучевая терапия может использоваться для лечения АВМ, особенно в случаях, когда другие методы могут быть слишком рискованными. Лучевая терапия направлена на уменьшение кровоточивости АВМ и может потребовать несколько сеансов.
- Медикаментозное лечение: В некоторых случаях могут быть применены лекарства для уменьшения симптомов, такие как боли или судороги. Медикаменты также могут использоваться для управления артериальным давлением с целью снижения риска кровоизлияния.
- Наблюдение и управление симптомами: В некоторых ситуациях, особенно если АВМ небольшая и не вызывает симптомов, может быть принято решение просто наблюдать за состоянием и управлять симптомами при необходимости.
Лечение АВМ должно быть индивидуально подобрано для каждого пациента, и решение о выборе метода зависит от конкретных обстоятельств. Важно обсудить все варианты лечения с медицинским специалистом и провести подробную оценку пациента, чтобы определить наилучший план лечения. Результаты лечения могут быть успешными, и пациенты могут достичь улучшения или полного выздоровления, однако каждый случай уникален.
Прогноз
Прогноз артериовенозной мальформации (АВМ) зависит от нескольких факторов, включая ее размер, местоположение, симптомы, возраст пациента и успешность лечения. Важно помнить, что АВМ - это медицинское состояние, которое может проявиться по-разному у разных пациентов, и прогноз может быть индивидуальным. Вот некоторые общие аспекты прогноза АВМ:
- Риск кровоизлияния: Главной опасностью АВМ является риск кровоизлияния (геморрагии) в головном мозге. Маленькие АВМ с низким риском кровоизлияния могут иметь хороший прогноз и не вызывать серьезных проблем. Однако большие и среднего размера АВМ могут представлять значительный риск.
- Симптомы: Симптомы, связанные с АВМ, такие как головные боли, судороги, паралич или нарушения чувствительности, могут оказать влияние на прогноз. В некоторых случаях успешное лечение может улучшить или устранить симптомы.
- Размер и местоположение: АВМ, расположенные в более опасных местах, например, в глубоких участках мозга или вблизи критически важных структур, могут иметь менее благоприятный прогноз. Однако даже многие крупные АВМ могут быть успешно лечены.
- Лечение: Лечение АВМ может включать хирургическое удаление, эмболизацию, лучевую терапию или медикаментозное лечение. Успешное лечение может снизить риск кровоизлияния и улучшить прогноз.
- Возраст: Возраст пациента также может влиять на прогноз. У детей и молодых людей часто есть более благоприятный прогноз, чем у пожилых пациентов.
- Сопутствующие заболевания: Наличие других медицинских состояний или факторов риска, таких как высокое артериальное давление или нарушения свертываемости крови, может влиять на прогноз и лечение АВМ.
Важно отметить, что АВМ требует внимательного медицинского наблюдения и лечения. Решение о методе лечения и прогнозе должно быть вынесено квалифицированным нейрохирургами и нейрорадиологами на основе обширной оценки каждого конкретного случая.


 [
[